Resumen 
La
abundancia y distribución son parámetros utilizados
para identificar a las especies raras. La rareza de las especies, y
por ende su distribución y abundancia, puede deberse tanto a
factores intrínsecos como extrínsecos. Este estudio
reporta el número total de individuos adultos y el rango de
distribución geográfica de Ecuadendron
acosta-solisianum,
una leguminosa arbórea, endémica de las tierras bajas
de la Costa del Ecuador. Así también, analiza la
influencia de las actividades antropogénicas en la reducción
de la distribución espacial de Ecuadendron.
El tamaño de sus poblaciones fue determinado usando
transectos variables ubicados en tres sitios al suroeste del Ecuador.
Su distribución espacial fue hipotetizada utilizando un modelo
del nicho ecológico (DOMAIN®), puntos
georeferenciados, cuatro variables climáticas y Sistemas de
Información Geográfica (SIG). Datos del uso de la
tierra (LU/LC) y herramientas provistas por ArcGIS® v.
9, permitió estimar la pérdida del hábitat para
la especie en estudio. Ecuadendron
fue encontrado raro en la naturaleza debido a su bajo número
de individuos adultos (< 200) y por su estrecho rango de
distribución geográfica. El modelo espacial
distribucional no sugiere la presencia de esta especie una región
que no sea diferente a las tierras bajas de la Costa. Por actividades
antropogénicas, Ecuadendron a perdido ~90% de su
hábitat natural.
Palabras claves: Ecuadendron,
tamaño de la población, distribución espacial,
modelo del nicho ecológico, pérdida del hábitat.
Abstract 
Abundance and distribution are commonly
found in the literature as standards to identify rare species. A
species may be rare either by factors intrinsic to the species'
biology or its rarity may be due to anthropogenic factors. The
present study reports the rarity of Ecuadendron
acosta-solisianum, a newly
described species of tree endemic to lowland coastal Ecuador. The
population size of Ecuadendron
was estimated using transects of variable area at Churute 1,
Churute 2 and Manta Real study sites in southwestern Ecuador. The
geographic distribution of this species was hypothesized applying an
ecological-niche model, DOMAIN®, based on
georeferenced points from fieldwork and from herbarium specimens.
Four climatic variables were used to the prediction model. In
addition, reduction in population size and spatial distributional
range of
Ecuadendron was
inferred from estimations of habitat loss where Geographic
Information Systems (GIS) tools, the predictive model and Land
Use/Land Cover (LU/LC) data were combined. Ecuadendron
was found in low abundance (< 200) at all of the study
areas. The ecological niche model does not suggest occurrence of this
species in a region different from coastal Ecuador. Due to past and
present land conversion, Ecuadendron
has lost almost 90% of its predicted natural habitat.
Keywords: Ecuadendron,
population size, spatial distribution, ecological niche model,
habitat loss.
Introducción 
El considerar el número de individuos en la evaluación del estado de conservación de las especies es esencial debido a las consecuencias genéticas y demográficas que presentan las especies con poblaciones de tamaño pequeño (Watkinson & Harper 1978; Goodman 1987; Carulli & Furbrothers 1988; Menges 1991). Se hipotetiza que la vulnerabilidad a los eventos ambientales, demográficos y genéticos al azar son aún más fuertes para las especies con poblaciones pequeñas. De allí que, se piensa que las especies raras (en términos de abundancia) son más propensas a la extinción (MacArthur & Wilson 1967; Terborgh & Winter 1980, Nitecki 1984; Shaffer & Samson 1985; Soulé 1987; Lande 1988; McKinney 1997). En el caso específico de las plantas, los estudios empíricos sugieren que las poblaciones pequeñas podrían tener consecuencias en los procesos ecológicos tales como polinización (Feinsinger et al. 1991; Kunin 1993; Ågren 1996; Hendrix & Kyhl 2000), y esto podría influenciar en los procesos evolutivos de la especie (Kunin 1997; Matthies et al. 2004). Cuando las especies de plantas son encontradas en bajo número, es posible también que presenten rangos geográficos restringidos (Main 1981; Reveal 1981; New 2000; pero ver Blackburn & Gaston 1997; Gaston 1997), los cuales son el resultado de requerimientos ecológicos también restringidos o específicos. En este sentido, se piensa que los modelos del nicho ecológico son claves en estructurar la abundancia y la distribución geográfica de las especies. Por ello, aunque los factores abióticos no son los únicos que determinan el nicho ecológico de una especie dada, estos pueden ser mapeados en áreas geográficas específicas, y por lo consiguiente son comúnmente usados en los modelos para determinar la distribución de especies (Carpenter et al. 1993).
En 1998, Ecuadendron acosta-solisianum D. A. Neill (Fabaceae), fue descrito como un género monotípico endémico de las Tierras Bajas del oeste del Ecuador (Neill 1998). Esta especie no solo es el único representante arbóreo endémico a nivel de género, sino que además esta catalogado como En Peligro en la naturaleza de acuerdo al Libro Rojo de las plantas endémicas del Ecuador (Valencia et al. 2000). En aquella primera descripción Ecuadendronfue reportado con un número total de individuos adultos menor a 100, en un rango elevacional de 300 - 350-m snm restringido a bosques húmedos y muy húmedos de la Costa ecuatoriana. Las poblaciones reportadas llegaban a tres, repartidas entre las provincias Esmeraldas, Guayas y Cañar (Neill 1998). Sin embargo, dado que poblaciones adicionales fueron encontradas en las provincias Guayas y Azuay, el presente estudio tiene como objetivo utilizar el tamaño poblacional y la distribución espacial real y potencial como parámetros para actualizar el estado de conservación de Ecuadendron. También se estimará la pérdida del hábitat para esta especie, en vista de que su bajo número de individuos y su distribución geográfica restringida podrían deberse a agentes extrínsecos, tales como, las actividades antropogénicas que han ejercido presión sobre los recursos naturales por décadas en esta región.
Materiales y Métodos 
Especie en estudio
Ecuadendron acosta-solisianum, es un árbol de dosel de aproximadamente 30m de alto cercanamente relacionado con Macrolobium y Brownea en la subfamilia Caesalpinioideae (Herendeen et al. 2003). Su corteza es café claro y su madera es densa y dura en la madurez. Sus hojas son enteras paripinnadas con pulvínulo basal. La inflorescencia es péndula, con ~50 flores resupinadas y puede llegar a medir hasta 2 m de largo, esta resupinación de las flores sugiere polinización por murciélagos (Neill 1998). Las semillas son grandes (2 - 3.0cm x 2.5 - 5.0cm), sin arilo ni endospermo y se presentan generalmente de 4 - 9 por legumbre. Se desconoce el dispersor aunque el tamaño de la semilla sugiere dispersión por roedores.

Figura 1: Inflorescencia péndula de Ecuadendron
acosta-solisianum. Sus estructuras florales sugieren polinización por
murciélagos
Area de estudio
Este estudio fue realizado en cinco cerros de la Reserva Ecológica "Manglares-Churute" (02°24'S, 79°40'W), perteneciente a la provincia Guayas, y en ocho haciendas en las cercanías del poblado de Manta Real, (02°33' S, 79°21'W), provincia Azuay y Cañar
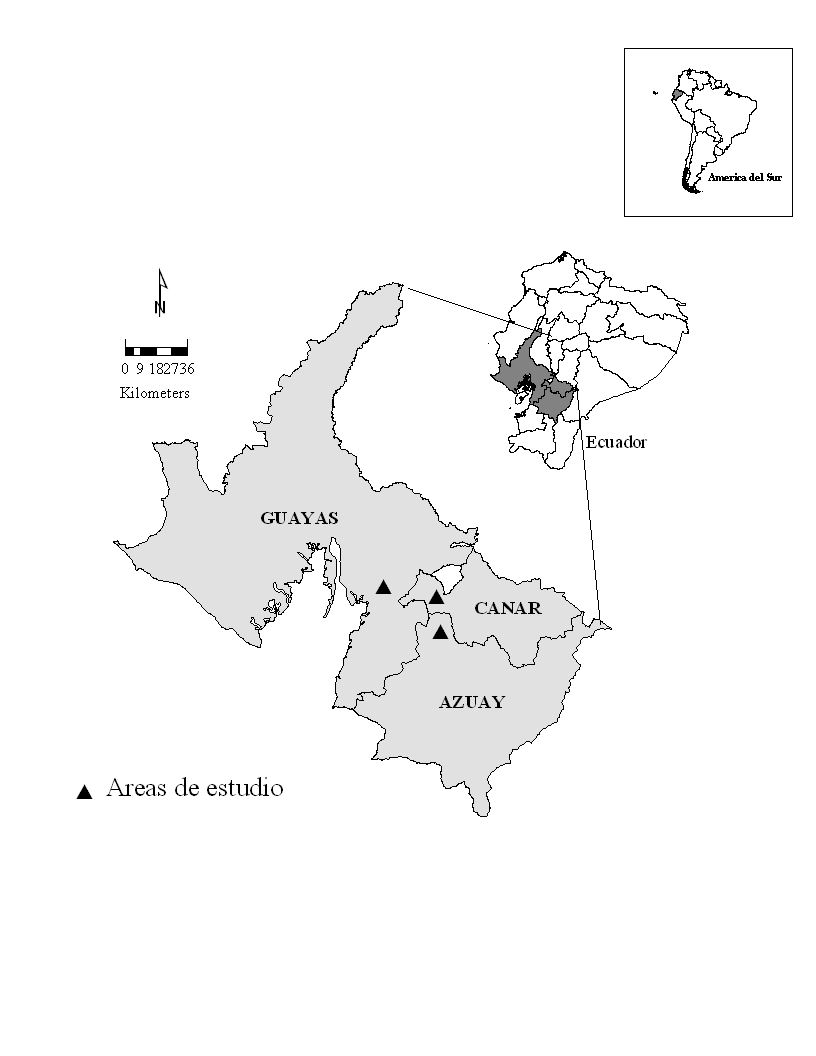
Figura 2: Ubicación de las
áreas de estudio. Cerros de la Reserva Ecológica Manglares-Churute, Provincia Guayas, y propiedades en las provincias Azuay y Cañar alrededor del poblado de Manta Real. Los cerros
de la R. E. Manglares-Churute correspondieron a: cerro Masvale y Pancho Diablo, considerados como
Churute 1, y Perequeté Grande, Simalón y El Mate, considerados como Churute 2
Los cerros de la Reserva Ecológica Manglares-Churute (REMCh) correspondieron a: cerro Masvale, Pancho Diablo, Perequeté Grande, Simalón y El Mate. De éstos el pico más alto correspondió al cerro Pancho Diablo (727m). Todos ellos son parte de "La Cordillera de Churute" que recibe la influencia de las subcuencas del Bulubulu-Taura, en el norte, y Churute, en el sur. La precipitación anual varía entre 1000 y 1500mm (Mejía et al. 1990), con concentraciones de lluvia entre Enero y Abril. Se estima una temperatura media anual de 25.6º C. La humedad mínima, media y máxima se ha registrado como 70%, 80%, y 85%, respectivamente. Los tipos de vegetación corresponden a Bosque Semideciduo de Tierras Bajas de la Costa y Bosque Siempreverde de Tierras Bajas de la Costa (Sierra 1999). Sobre los 450-m snm, los cerros Masvale, Pancho Diablo y Simalón se caracterizan por presentar una bruma densa y una garúa persistente (INEFAN - FUNDACION NATURA / ECOLAP/USFQ 1999).
Las haciendas en el sector de Manta Real se encuentran entre un rango altitudinal de 300m - 1105m, distribuidas entre un complejo de montañas con uno de los más grandes remanentes de bosque al occidente de los Andes. La temperatura anual varía entre 18˚ y 22˚ C (Factos 2000). La estación lluviosa va de Diciembre a Abril. La vegetación de esta área corresponde a Bosque Siempreverde de Tierras Bajas de la Costa y Bosque Siempreverde Piemontano de la Costa (Sierra 1999).
Todas estas áreas pertenecen al complejo "Darién-Chocó-Western Ecuador" considerado como uno de los mundialmente conocidos "hotspots" (Mittermeier 1999; Myers et al. 2000).
Diseño del estudio
El trabajo de campo se condujo desde Junio hasta mediados de Agosto de 2003. Dos de los cinco cerros de la REMCh (Masvale y Pancho Diablo) fueron tratados como Churute 1, y el resto de cerros (Perequeté Grande, Simalón y Mate) como Churute 2. Las propiedades privadas en las cercanías de Manta Real comprendieron la tercera área de estudio.
Para estimar el tamaño de la población de Ecuadendron, establecí transectos variables (Foster et al. 1998; Peña-Claros 2003) a lo largo de un rango total altitudinal de 20m - 1105m [[Tabla 1]], considerando las tres áreas de estudio juntas. Este método es una técnica de muestreo flexible que permite fijar un número de individuos indistintamente del tamaño del área. Para este estudio, utilicé 50 individuos adultos por transecto como estándar para delimitar el largo del transecto. Los transectos empezaron a 20-m snm en Churute 1 y en Churute 2, y a 300-m snm en Manta Real. A lo largo de cada transecto, primero busqué los individuos adultos en una distancia de hasta 500-m desde la línea central del transecto. El muestreo completo en cada transecto se llevó a cabo por varios días.
Para predecir la distribución espacial potencial de Ecuadendron acosta-solisianum apliqué el modelo del nicho ecológico DOMAIN® 1.4 (Carpenter et al. 1993), el cual mapea áreas de similitud y produce patrones de distribución usando registros de ocurrencia y un limitado número de atributos biofísicos (Carpenter et al. 1993, Loiselle et al. 2003). Para este modelo, utilicé 142 puntos georeferenciados de presencia de la especie y cuatro variables bioclimáticas, datum WGS84, a 30 segundos de resolución espacial, obtenidas de la base de datos WorldClim 1. 3 (Hijmans et al. 2004). Las variables bioclimáticas escogidas representan una combinación de temperatura, precipitación y humedad en diferentes épocas del año, y correspondieron a: 1) Temperatura promedio del cuarto más húmedo, 2) Temperatura promedio del cuarto más seco, 3) Precipitación del cuarto más cálido, y 4) Precipitación del cuarto más frío. Un cuarto representa un período de tres meses. El modelo predictivo final fue preparado utilizando las herramientas del programa de ESRI®, ArcMap™ 8.2
Análisis de datos
Para estimar el área muestreada se usó las herramientas del ESRI® ArcMap™ 9.0 creando un polígono con los puntos georeferenciados más externos de cada transecto. Para el modelo de distribución potencial se convirtió el mapa predictivo DOMAIN® en un mapa binario asignando nuevos valores a todas las celdas. Así, las celdas con valores < 95 fueron reclasificadas como 0, equivalente a sitios no aptos para el desarrollo de la especie, y las celdas con valores de 95 - 100 fueron reclasificadas como 1 (sitios apropiados). La reducción del hábitat de Ecuadendron fue estimada con una herramienta para calcular área en ArcView 3.2 (Zhou 2001).
Resultados y Discusión 
Tamaño de la población
Un total de 2,692 individuos de Ecuadendron fueron muestreados, 163 de los cuales correspondieron a individuos adultos encontrados en ocho de los 16 transectos muestreados, es decir, en un transecto en Churute 1, en dos transectos en Churute 2, y en cinco transectos en Manta Real. En todas las áreas de estudio, Ecuadendron estuvo presente en densidades < 1 individuos adultos ha-1. La densidad de individuos adultos fue mayor en el área de Manta Real, y Churute 2 tuvo una densidad de adultos más alta que Churute 1, aunque el área muestreada de Churute 1 fue mayor que la de Churute 2. Para Manta Real, este resultado contrasta con la descripción hecha por Foster (1992) quien reporta a esta especie (identificada como Browneopsis) como dominante bajo los 400-m snm. Esta observación responde a una evaluación rápida del área hecha hace más de doce años. Para Churute 1 y Churute 2, no existen referencias con las cuales se puedan hacer comparaciones, solo inventarios parciales que reportan 25 especies de árboles maderables pertenecientes a las familias Bignoniaceae, Fabaceae, Lauraceae, Rhizophoraceae y Sapotaceae, que no mencionan datos sobre frecuencias (INEFAN - FUNDACION NATURA / ECOLAP/USFQ 1999). La baja densidad de Ecuadendron podría más bien deberse a las constantes actividades antropogénicas en estas áreas, aunque la co-existencia de especies de árboles en bajas densidades parece ser un patrón común en las comunidades de bosques tropicales con alta diversidad y alto endemismo (Cody 1986; Gentry 1986; Pitman et al. 1999).
Distribución potencial
El modelo distribucional sugiere una presencia discontinua de la especie en 129,164 ha de bosque al oeste del Ecuador. Los lugares aptos para el establecimiento de la especie se extienden más allá del suroeste de los límites de la provincia Esmeraldas y el noroeste de la provincia Guayas pasando por la provincia de Manabí (Fig. 3). Su presencia se extiende hacia la provincia Manabí donde los tipos de vegetación corresponden a: Bosque Siempreverde Piemontano de la Costa, Bosque Siempreverde Piemontano de la Cordillera de la Costa, Bosque Siempreverde Montano Bajo de la Costa, Bosque Deciduo de Tierras Bajas de la Costa, Bosque Semideciduo de Tierras Bajas de la Costa, y Bosque Nublado Montano Bajo (Sierra 1999)]]. Los tipos de vegetación de estas potenciales nuevas áreas de ocurrencia corresponden a: Bosque Siempreverde Piemontano de la Costa, Bosque Siempreverde Piemontano de la Cordillera de la Costa, Bosque Siempreverde Montano Bajo de la Costa, Bosque Deciduo de Tierras Bajas de la Costa, Bosque Semideciduo de Tierras Bajas de la Costa, y Bosque Nublado Montano Bajo (Sierra 1999).
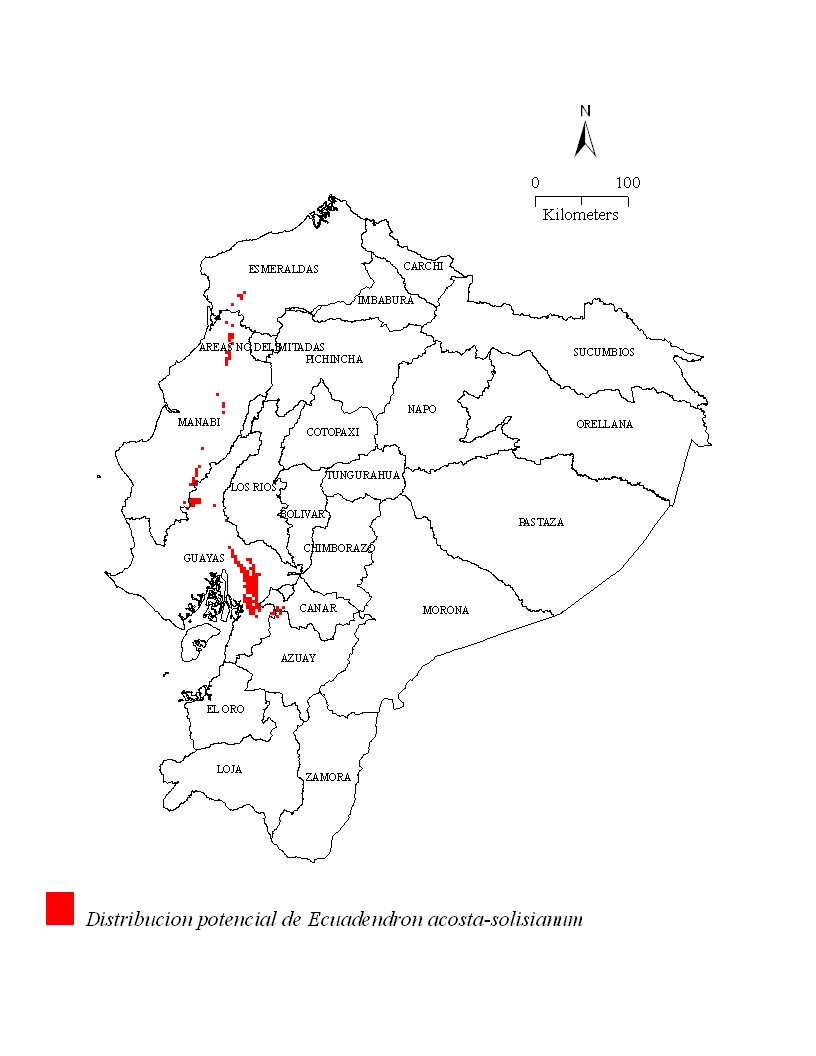
Figura 3: Distribución potencial de
Ecuadendon acosta-solisianum de acuerdo al modelo
predictivo DOMAIN®.
Reducción del hábitat
Se estima que la especie se encuentra presente en sólo 13,328 ha de las 129,164 ha de occurrencia representadas en el modelo del nicho ecológico (Fig. 4). Las áreas remanentes corresponden principalmente a los bosques al norte de la provincia Esmeraldas. Los causantes más comunes de la pérdida del hábitat en la provincia Azuay y Cañar incluyen la conversión de tierra a plantaciones, la extracción local actual de especies maderables, así como también el impacto de explotaciones previas de palmas del género Geonoma, Jessenia, Pholidostachys, y miembros de las familias Bombacaceae, Lauraceae and Meliaceae (Factos 2000). En la provincia Guayas, también se dió la extracción local antes del establecimiento de la Reserva Ecológica Manglares-Churute en 1979 (INEFAN-FUNDACION NATURA/ECOLAP/USFQ 1999).
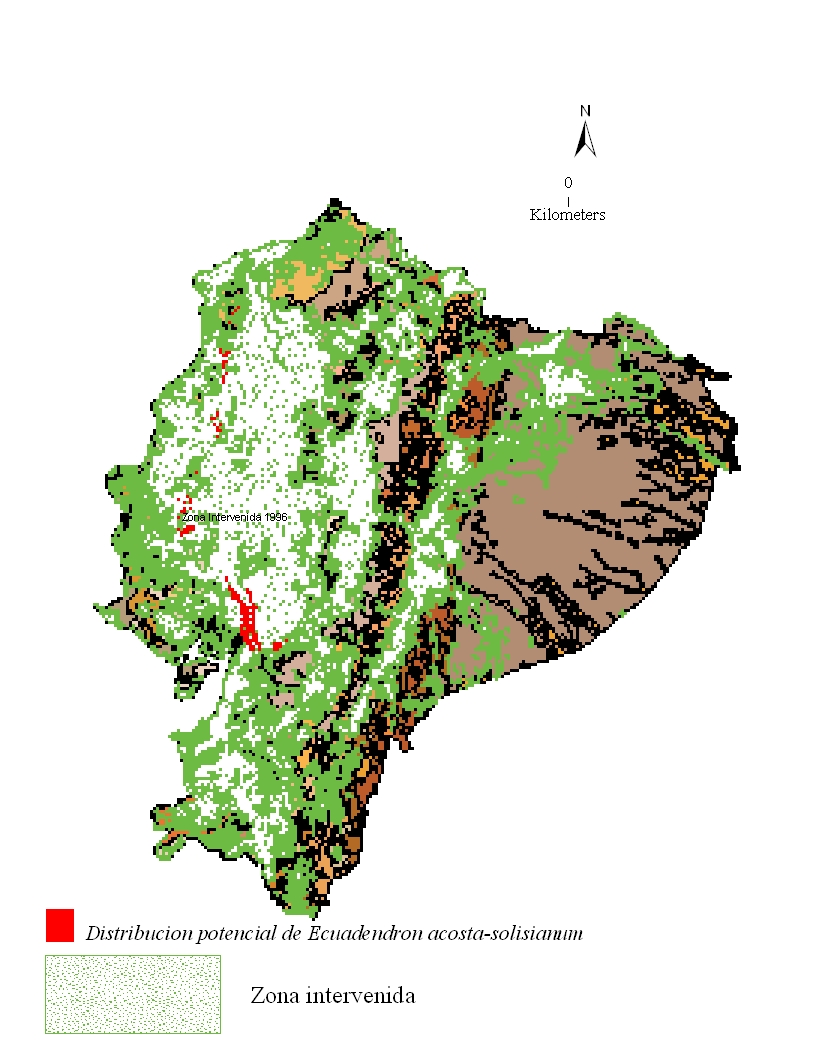
Figura 4: Pérdida del hábitat de Ecuadendron
acosta-solisianum. De norte a sur, se estima que la especie se mantiene en 13,328 ha de
bosque en las provincias Esmeraldas, Manabí, Guayas, Azuay y Cañar, lo cual corresponde a
apenas el 10% de su distribución potencial
Conclusiones 
Este estudio constituye el primer intento en caracterizar las poblaciones de Ecuadendron acosta-solisianum en la naturaleza después de que fuera taxonómicamente descrita en 1998. Esta especie fue encontrada rara en la naturaleza debido a su bajo número de individuos y a su distribución geográfica restringida, aunque se registraron nuevas poblaciones y su rango elevacional de presencia se amplió de 300 - 350-m snm a 170 - 600-m snm de un rango total muestreado de 20 - 1105-m snm.
La presencia de Ecuadendron en menos de un individuo reproductivo por hectárea y su distribución en pocos remanentes de bosques en el occidente de Ecuador, puede responder a factores inherentes a su propia biología. Además, las especies raras parecen ser una característica común en las regiones con alto endemismo como las Tierras Bajas del oeste de Ecuador (Cody 1986; Gentry 1986). Sin embargo, esta distribución y baja densidad no sólo estaría influenciada por parámetros biológicos y/o biofísicos como el clima, si no también por agentes extrínsecos, tales como los altos índices de deforestación que esta región ha sufrido. De mantenerse esta tendencia, las poblaciones de Ecuadendron no podrán permanecer estables por generaciones y estarían condenadas a la extinción. Estas características, es decir, tamaño poblacional pequeño y distribución geográfica restringida, agravadas por la pérdida del hábitat, ponen a Ecuadendron en un estado crítico de extinción, por lo que las Reservas Ecológicas en las que se encuentran algunas de las poblaciones de Ecuadendron ofrecen una gran oportunidad para implementar programas para la conservación in situ de esta leguminosa endémica del Ecuador.
Agradecimientos 
Agradezco a la Elizabeth Bascom Fellowship y al Missouri Botanical Garden sin cuyo financiamiento y apoyo esta investigación no habría sido posible. La fase de campo fue realizada con fondos de la Baltzer Fellowship y del International Center for Tropical Ecology (ICTE) de la University of Missouri-Saint Louis. Un especial agradecimiento a Bette Loiselle, Kimberlie McCue y David Neill por sus comentarios y discusiones durante la preparación de los borradores de este trabajo. De la misma manera, agradezco a la especialista en SIG, Trisha Consiglio, del Missouri Botanical Garden, por su significativo aporte en las aplicaciones de las diferentes versiones de ArcView®. Rodrigo Sierra de la University of Texas, generosamente facilitó los mapas de uso de tierra y cobertura vegetal. Agradezco al Ministerio del Ambiente del Ecuador, especialmente a la Blga. Mireya Pozo, y a los funcionarios y guardaparques de la Reserva Ecológica Manglares-Churute por el soporte logístico. Así mismo, agradezco a Freddy Villao por la asistencia de campo, y a Digna Palacios, Rodrigo Prado y Bolívar García, por permitirme el acceso a sus propiedades en el área de Manta Real. Cabe resaltar el apoyo de los miembros del Jardín Botánico de Guayaquil, especialmente de Arcadio Arosemena y Marcelo Bejarano. Finalmente agradezco los comentarios y observaciones de mis colegas Carlos Daniel Cadena, Renata Durães, José Fabara, Patricia Feria, Kimberly Holbrook, Andrea Loaiza, Fátima Piña-Rodriguez, Seema Shet y Wendy Tori.
Referencias 
Ågren, J. 1996. Population size, pollinator limitation, and seed set in the self incompatible herb Lythrum salicaria. Ecology 77 (6): 1779-1790. Blackburn, T. M. & K. J. Gaston. 1997. Who is rare? Artifacts and complexities of rarity determination. Pp. 48-69 en: W. E. Kunin & K. J. Gaston (eds.). The biology of rarity. Chapman and Hall. London. Carpenter, G.; A. N. Gillison & J. Winter. 1993. DOMAIN: a flexible modeling procedure for mapping distribution of plants and animals.
Carulli, J. P. & D. E. Furbrothers. 1988. Allozyme variation in three eastern US species of Aeachynomene (Fabaceae), including the rare A. virginica. Systematic Botany13: 559-566.
Cody, M. 1986. Diversity, rarity and conservation in Mediterranean-climate regions. Pp. 122-152 en: M. E. Soulé (ed.). Conservation Biology: The science of scarcity and diversity. Sinauer Assoc., Sunderland, MA.
Factos, M. 2000. Alternativas de manejo para la conservación del Bosque Protector Molleturo-Mullopungo Comunidad Manta Real. Fundación Natura/PNUD/Comunidad de Manta Real.
Feinsinger, P.; H. M. Tiebout & B. E. Young. 1991. Do tropical bird-pollinated plants exhibit density-dependent interactions? Field experiments. Ecology (72): 1953-1963.
Foster, R. B. 1992. Biogeographic overviews. Vegetation. Pp. 58 en: T. A.
Parker III & J. L. Carr (eds.). Status of the forest remnants in the Cordillera de la Costa and adjacent areas of southwestern Ecuador. Conservation International. RAP Working Papers 2.
Foster, R.; N. Hernández; E. Kakudidi & R. Burnham. 1998. Rapid assessment of tropical plant communities using variable transects: an informal and practical guide (ms. unpublished). Gaston, K. J. 1997. What is rarity? Pp. 30-47 en: W. E. Kunin & K. J. Gaston (eds.).The Biology of rarity. Chapman and Hall. London.
Gentry, A. H. 1986. Endemism in tropical versus temperate plant communities. Pp. 153-181 en: M. E. Soulé (ed.). Conservation Biology: The science of scarcity and diversity. Sinauer Assoc., Sunderland, MA.
Goodman, D. 1987. The demography of chance extinction. Pp. 11-34 en: E. M. Soulé (ed.). Viable populations for conservation. Cambridge University Press. Cambridge.
Hendrix, S. D. & J. F. Kyhl. 2000. Population size and reproduction in Phlox pilosa. Conservation Biology 14 (1): 304-313.
Herendeen, P. S.; A. Bruneau & G. P. Lewis. 2003. Phylogenetic relationships in thecaesalpinioid legumes: a preliminary analysis based on morphological and molecular data. In: B. B. Klitgaard and A. Bruneau (editors). Advances in Legume Systematics, part 10, Higher Level Systematics. Pp. 37'62. Royal Botanic Gardens, Kew.
Hijmans, R. J.; S. Cameron & J. Parral. 2004. Worldclim, version 1.2. A square kilometer resolution database of global terrestrial surface climate. Available at http://biogeo.berkeley.edu/
INEFAN - FUNDACI-N NATURA/ECOLAP - USFQ, 1999. Plan de manejo de la Reserva Ecológica Manglares-Churute. Divaprint. Quito.
Kunin, W. E. 1993. Sex and the single mustard: population density and pollinator behavior effects on seed-set. Ecology (74): 2145-2160.
Kunin, W. E. 1997. Population size and density effects in pollination: pollinator foraging and plant reproductive success in experimental arrays of Brassica kaber. Journal of Ecology 85: 225-234.
Lande, R. 1988. Genetics and Demography in Biological Conservation. Science 241: 1455-1459.
Loiselle, B. A.; C. A. Howell; C. H. Graham; J. M. Goerck; T. Brooks et al. 2003. Avoiding pitfalls of using species distribution models in conservation planning. Conservation Biology 17 (6): 1591-1600.
MacArthur, R. H. & E. O. Wilson. 1967. The theory of island biogeography. Princeton Univ. Press, Princeton.
Main, A. R. 1981. Rare species: Precious or dross? Pp. 163'174 en: R. H. Groves & W. D. L. Ride (eds.). Species at risk. Research in Australia. Springer-Verlag Berlin Heidelberg New York.
Matthies, D.; I. Bräuer; W. Maibom & T. Tscharntke. 2004. Population size and the risk of local extinction: empirical evidence from rare plants. Oikos 105: 481-488.
McKinney, M. L. 1997. Extinction vulnerability and selectivity: combining ecological and paleontological views. Annual Reviews of Ecology and Systematics 28: 495-516. Annual Reviews Inc.
Mejía, L. E.; J. Acosta & P. de la Torre. 1990. Estudio de cambios en el uso del suelo. Fundación Natura. Quito.
Menges, E. S. 1991. Seed germination percentage increases with population size in a fragmented prairie species. [[i+]Conservation Biology5: 158-164.
Mittermeier, R. A.; N. Myers & C. G. Mittermeier. 1999. Hotspots. Earth's Biologically Richest and Most Endangered Terrestrial Ecoregions. Conservation International.
Myers, N.; R. A. Mittermeier; C. G. Mittermeier; G. A. B. da Fonseca & J. Kent. 2000. Biodiversity hotspots for conservation priorities. Nature 403: 853-858.
Neill, D. A. 1998. Ecuadendron (Fabaceae: Caesalpinioideae: Detarieae): A new arborescent genus from Western Ecuador. Novon 8: 45-49.
Nitecki, M. H. (ed.). 1984. Extinctions. University of Chicago Press. Chicago.
Peña-Claros, M. 2003. Changes in forest structure and species composition during secondary forest succession in the Bolivian amazon. Biotropica 35(4): 450-461.
Pitman, N.C.; A. J. Terborgh; M. R. Silman & P. Nuñez. 1999. Tree species distribution in an upper amazonian forest. Ecology 80(8): 2651-2661.
Reveal, J. L. 1981. The concepts of rarity and population threats in plant communities. Pp. 41-47 en: L. E. Morse & M. S. Henifin (eds.). Rare plant conservation: Geographical data organization. The New York Botanical Garden. New York.
Shaffer, M. L. & F. B. Samson. 1985. Population size and extinction: a note on determining critical population sizes. The American Naturalist 125(1): 144-152.
Sierra, R. (ed.). 1999. Propuesta preliminar de un Sistema de Clasificación de Vegetación para el Ecuador Continental. Proyecto INEFAN-GEF-BIRF y EcoCiencia. Quito, Ecuador.
Soulé, M. E. (ed.). 1987. Viable populations for conservation. Cambridge
University Press. Cambridge.
Terborgh, J. & B. Winter. 1980. Some causes of extinction. Pp. 119-133 en: M. E. Soulé& B. Wilcox (eds.). Conservation Biology: an ecological-evolutionary perspective. Sinauer Assoc. Sunderlan, MA.
Valencia, R.; N. Pitman; S. León-Yánez & P. M. Jørgensen (eds.). 2000. Libro rojo de las plantas endémicas del Ecuador 2000. Herbario QCA, Pontificia Universidad Católica del Ecuador, Quito.
Watkinson, A. R. & J. L. Harper. 1978. The demography of a sand dune annual: Vulpia fasciculata. I. The Natural regulation of populations. Journal of Ecology 66: 15-33.
Zhou, G. 2001. Area calculation for polygons. http://gis.esri.com/arcscript.cfm.
Table 1. Gradiente altitudinal de la ubicación de los transectos variables en los sitios de estudio Churute 1, Churute 2 y Manta Real.
Area Nombre del transecto CHURUTE 1 |
Número del transecto | Gradiente altitudinal (m) |
|
Cerro
Masvale Masvale |
1 |
20 - 640 |
| Cerro Pancho Diablo |
|
|
Cumbre 1 Cumbre 2 Mango |
3 |
20 - 727 |
| CHURUTE 2 |
|
|
Cerro Perequeté P-Grande |
1 |
20 - 408 |
Cerro Simalón Carrillo-Toro Maridueña |
2 |
20 - 668 |
Cerro El Mate Mate |
1 |
20 - 337 |
MANTA REAL |
|
|
B-García |
1 | 300 - 625 |
S-Prado |
1 | 360 - 950 |
La Aurora |
1 | 400 - 480 |
R-Prado |
1 | 520 - 650 |
Caimatán |
1 | 560 - 630 |
Paquisha-La Victoria |
1 | 520 - 900 |
Sanaguín |
1 | 600 - 1105 |