Resumen 
De las 175 especies vegetales
endémicas de las Islas Galápagos 23 se encuentran en
peligro crítico de extinción de acuerdo a los criterios
de la UICN. Frente a esta realidad, el Parque Nacional Galápagos
ha optado por la micropropagación vegetal como una estrategia
para la conservación de especies endémicas.
Para este trabajo se han escogido
dos especies de la familia Asteracea en peligro crítico de
extinción: Darwiniothamnus alternifolius y Scalesia
affinis.
Para el análisis
estadístico se está utilizando un diseño
completamente al azar (DCA) con tres observaciones. La unidad
experimental para cada observación está constituida por
cuatro tubos de ensayo de 150 x 25 mm conteniendo 10 ml de medio
Murashige-Skoog y un explante en cada tubo. Se han probado tres tipos
de explantes: yemas, capítulos y flósculos.
Con los diferentes métodos
de desinfección propuestos aun se presenta un alto índice
de contaminación por lo que se continúa la evaluación
de nuevos tratamientos desinfectantes con menor concentración
de NaOCl más 5 gotas de Tween 20. La adición de 0.1%
p/v de carbón activado al medio ha ayudado a la adsorción
de fenoles exudados por los explantes al ser sembrados. Se seguirá
probando más tratamientos desinfectantes hasta encontrar un
protocolo óptimo y continuar con las siguientes etapas de
propagación hasta trasladarlas a sus respectivos lugares de
origen.
Palabras
Clave: explante, medio MS, desinfección, amenazadas,
conservación
Abstract 
From the 175 plant species
endemic of the Galapagos Islands, 23 are facing critical risk of
extinction according with the IUCN criteria. The Galapagos National
Park has started micropropagation techniques as a strategy to
conserve threatened endemic species.
For the
current study, two critically endangered Asteracea species have been
chosen: Darwiniothamnus alternifolius and Scalesia affinis.
Experiments were carried out in a
random design with three replicates. The experimental unit consisted
of four 150 x 25 mm tests tubes containing 10 ml of Murashige-Skoog
medium and one explant per tube. Three types of explants are being
tested: capitula, florets and buds. High contamination or lethal
browning levels were found with all three different treatments. New
disinfection treatments are currently being tested with a lower
concentration of NaOCl and five drops of Tween 20 for each treatment.
Adding 0.1% activated charcoal has decreased phenol exudates due to
its adsorption properties. More disinfecting treatments will be
applied until being able to continue with the stages of
multiplication and rooting.
Key
words: explant, MS medium, disinfection, conservation, threatened
Introducción 
Uno de los principales atractivos de las Islas Galápagos es su biodiversidad única en el mundo que la ha convertido desde 1978 en Patrimonio Natural de la Humanidad según la UNESCO. Con respecto a la diversidad florística del archipiélago, está constituída por 560 especies de plantas nativas, y de éstas 175 especies (32%), son endémicas y abarcan 236 taxones (Tye, 2002). Entre estos taxones se encuentran inclusive géneros que son endémicos de las islas: Darwiniothamnus, Lecocarpus, Macraea y Scalesia (Asteraceae); Brachycereus y Jasminocereus (Cactaceae) y Sicyocaulis (Cucurbitaceae) (McMullen, 1999).
Desafortunadamente, de toda esta riqueza natural y particular endemismo, más del 20% de plantas están categorizadas como especies en peligro de extinción (EN, 21 especies) o en peligro crítico de extinción (CR, 13 especies) de acuerdo a los criterios de la Unión Internacional para la Conservación de la Naturaleza (UICN) publicados a finales del 2001 (Tye, 2002).
En este contexto, la micropropagación resulta una estrategia interesante puesto que permite trabajar con especies cuyas poblaciones naturales son muy limitadas en las cuales la colección de semillas puede ser una acción que va en detrimento de la sobrevivencia en forma silvestre (Clemente, 1999).
Materiales y Métodos 
Muestras de Darwiniothamnus alternifolius fueron colectadas en el volcán Sierra Negra, al sur de la Isla Isabela. En esta misma Isla se colectaron especimenes de Scalesia affinis de Puerto Villamil donde la especie no se encuentra en peligro crítico de extinción. Además se ha trabajado con muestras de D. tenuifolius cuyo estado es NT (casi amenazada) (Valencia, 2000) colectadas en la Isla Santa Cruz. Todo el material vegetal colectado se almacenó previo a su manipulación a 4ºC (Sands, 2003).
Explantes y Desinfección
Se ha trabajado con tres tipos de explantes: capítulos (c), flósculos (f) y yemas (y). Los explantes fueron lavados superficialmente con agua destilada estéril y 1-2 gotas de Tween 20. En cámara de flujo laminar se lavaron con etanol 70% por un minuto y tres enjuagues con agua destilada estéril. Posteriormente se aplicaron para cada explante tres diferentes tratamientos de desinfección: d1. NaOCl 3% (v/v) 5 min, tres enjuagues con agua destilada estéril, d2. NaOCl 3% + ácido láctico 1.4% (v/v) 5 min, d3. NaOCl 3%, tres enjuagues en agua destilada estéril, H2O2 10 vol. 1 min y tres enjuagues con agua destilada estéril.
Al terminar el último enjuague los capítulos se disecan en 4 o 6 partes de acuerdo a su tamaño, y se extraen además flósculos individuales. Los tallos son disecados en porciones de 1-2 cm dejando de una a tres yemas por segmento dependiendo del material, y eliminando los extremos que presenten tejido afectado por los desinfectantes.
Los explantes fueron finalmente sembrados en tubos de ensayo de 150 x 25 mm conteniendo 10 ml de medio MS (Murashige-Skoog, 1962) sin reguladores de crecimiento. El pH fue ajustado a 5.8 utilizando 1 N NaOH/ 1 N HCl antes de autoclavar a 15 PSI durante 15 minutos y se adicionó 3% de sacarosa y 0.7% de agar. Se utilizaron cuatro tubos por tratamiento con seis repeticiones para D. alternifolius y S. affinis, y tres repeticiones para D. tenuifolius. Finalmente se transfierieron los tubos al cuarto de crecimiento mantenidos a 25ºC, un fotoperíodo de 16 h con lámparas fluorescentes de luz blanca e inspeccionados diariamente.
Resultados y Discusión 
Los tratamientos desinfectantes permitieron alcanzar un alto número de flósculos libres de contaminación sobre todo para las dos especies de Darwiniothamnus (tabla 1). Estos explantes fueron transferidos a medio MS con diferentes concentraciones de benzyl amino purina (BAP) y ácido indol acético (IAA) sin encontrarse desarrollo en ninguno de los tratamientos después de ocho semanas de observación.
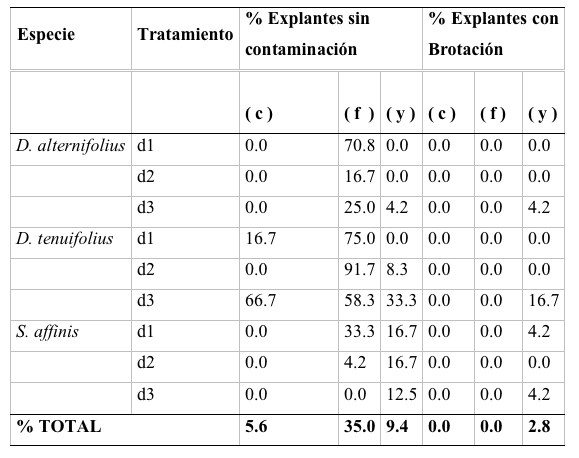
Tabla 1.
Porcentaje de explantes libres de contaminación y porcentaje de brotación de los explantes sembrados para las tres especies.
En cuanto a los capítulos y yemas, ambos tipos de explantes presentaron porcentajes de contaminación altos (figura 1), que impidieron un desarrollo posterior aun al colocarlos en soluciones con reguladores de crecimiento. La única excepción a este resultado se dio con el material obtenido de D. alternifolius sin contaminación que desarrolló brotes al colocarlo en medio MS con 0.5mg L-1 BAP y 0.5mg L-1 IAA.
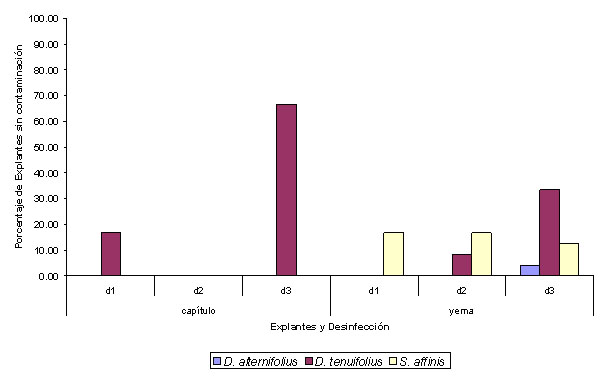
Figura 1.
Porcentaje de explantes libres de contaminación luego de la
aplicación de tres diferentes tratamientos de desinfección
en tres tipos de explantes de D. alternifolius, D. tenuifolius y S.
affinis.
A pesar de la contaminación se observaron brotes a partir de explantes de yemas aun estando en medio MS sin reguladores de crecimiento (figura 2) pero finalmente murieron. En muchos de los explantes libres de contaminación se presentó exudación de fenoles en un alto porcentaje, principalmente en capítulos.
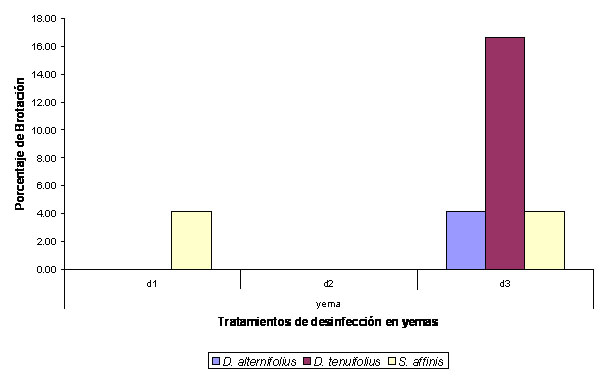
Figura 2.
Porcentaje de brotación observado en yemas de D.
alternifolius, D. tenuifolius y S. affinis
sembrados en MS sin reguladores de crecimiento.
En base a los resultados obtenidos hasta el momento, se continuará con la evaluación de yemas en principio de D. tenuifolius buscando un tratamiento desinfectante que permita obtener mayor cantidad de material vegetal para las siguientes etapas de brotación y enraizamiento y aplicarlas a las otras dos especies. Los tratamientos actualmente en evaluación tienen una menor concentración de hipoclorito de sodio y un mayor tiempo de exposición de los explantes al desinfectante. Además, se ha añadido 5 gotas de Tween 20 a todos los tratamientos para ayudar a romper la tensión superficial del agua y aumentar así el contacto con el tejido vegetal (Kyte, 1996).
Para contrarrestar el fenómeno de la fenolización se añadió al medio MS 0.1 % de carbón activado por su capacidad de adsorción de sustancias obteniéndose resultados positivos (George, 1993). Adicionalmente, previa a la desinfección se realizará una inmersión en sustancias antioxidantes que pueden ser útiles en la prevención de polimerización de quinonas reduciendo la posibilidad de reacción con proteínas en el medio de cultivo (Crompton & Preece, 1986).
Conclusiones 
- El medio MS permite el desarrollo de brotes en explantes de yema incluso sin reguladores de crecimiento por lo que es un medio adecuado para trabajos de micropropagación con estas especies.
- La adición de 0.5 mg L-1IAA y 0.5 mg L-1 BAP en el medio MS promueve el desarrollo de múltiples brotes a partir de una yema axilar en D. alternifolius.
- El medio MS con diferentes concentraciones de IAA y BAP no ha promovido crecimiento activo en explantes de flósculos.
Agradecimientos 
Al Parque Nacional Galápagos, Concepto Azul y Ecociencia por el apoyo tanto financiero como logístico para la realización del presente trabajo.
Referencias 
Clemente, M. 1999. In Vitro Culture and Plant Conservation. In: B.G. Bowes (Ed.) A Color Atlas of Plant Propagation and Conservation. Manson Publishing Ltda, London. pp. 224.
Crompton M.E & J.E. Peerce 1986 Exudation and explant establishment. I.A.P.T.C. Newsletter 50: 9-18.
George, E. 1993. Plant Propagation by Tissue Culture. Second/Ed. Exegetic Ltda., Edington, England.
Kyte, L. & J. Klein. 1996. Plants from Test Tubes. An Introduction to Micropropagation. Tercera/Ed. Timber Press, Portland, Oregon.
McMullen, C.K. 1999. Flowering Plants of the Galapagos. First/Ed. Cornell University Press, Ithaca, New York.
Murashige, T.; M. Serpa, & J.B. Jones. 1974. Clonal multiplication of Gerbera trough tissue culture. In D. Hurtado & M. Merino (Eds.). Cultivo de Tejidos Vegetales. Editorial Trillas, Mexico DF. pp. 15-30.
Sands, R. J.; N.R. Brown & A. Koutoulis. 2003. Micropropagation of two threatened Tasmanian species of Calocephalus (Asteraceae), with comments on phenotypic plasticity. Australian Journal of Botany 51: 415-420.
Tye, A. 2002. Revisión del Estado de Amenaza de la Flora Endémica de Galápagos. In "Informe Galápagos 2001-2002". Fundación Natura - WWF, Quito, Ecuador. pp. 116-122
Valencia, R.; N. Pitman; S. León-Yánez & P.M. Jørgensen (Eds). 2000. Libro rojo de las plantas endémicas del Ecuador. Herbario QCA, Pontificia Universidad Católica del Ecuador, Quito.