Introducción

La floración es el inicio de una nueva etapa reproductiva en
las planta; en la cual, una secuencia de cambios fisiológicos
y morfológicos, trasforman un ápice vegetativo en un
ápice reproductivo (Raven et al. 1999). Al analizar este
proceso a nivel de comunidad, cada individuo funciona en coordinación
con el ambiente. Estudios fenológicos realizados en bosques
tropicales con estaciones marcadas, han demostrado que la producción
de flores del bosque es controlada por los cambios en las condiciones
climáticas que favorecen la germinación y el
establecimiento de un nuevo individuo (Garwood 1983; Foster 1990;
Wright 1996). Pero ¿Qué sucede en los bosques
amazónicos que se caracterizan por no tener una estacionalidad
marcada que restringa o sincronice los eventos reproductivos?
El presente estudio analiza la floración
de un bosque no estacional de la Amazonía Ecuatoriana, evalúa
el comportamiento de la floración a nivel de comunidad y
explora su relación con los factores climáticos más
importantes. Además compara los eventos de floración en
diferentes formas de vida, en distintos estratos, y en diferentes
niveles topográficos. Y por último verifica si existe
sincronía en la floración de especies relacionadas.
Materiales y Métodos

El presente estudio se realizó desde febrero del 2000 a marzo
del 2001, dentro del Parque Nacional Yasuní, al nor oriente de
la Amazonía Ecuatoriana. Esta área comprende un bosque
húmedo, siempre verde, de tierras bajas (Sierra 1999), que
según la clasificación Bio climática de
Cañadas-Cruz (1983), se encuentra en la región Muy
húmeda Tropical. La muestra de bosque tropical en donde
se realizó este estudio fue una parcela de 50 ha, establecida
en un bosque de tierra firme, por el Proyecto Dinámica de
Bosque Yasuní (PDBY), a 00°38'S y 76°30'W. Los
inventarios de árboles y arbustos con diámetro a la
altura del pecho (DAP) 1cm, en
dos héctareas de la parcela, muestran como las especies más
comunes a Rinoria lindeniana, Matisia oblongifolia,
Marmaroxylon basijugum, Iriartea deltoidea y Matisia
malacocalyx (Romoleroux et al. 1997).
El clima de la región es cálido, húmedo sin
estaciones marcadas. La precipitación media anual es de 2826
mm. Aunque se considera al clima de esta región como no
estacional, existen meses que son más lluviosos que otros.
Este es el caso de mayo y junio, donde el nivel de precipitación
llega a los 400 mm mientras que los meses más secos
corresponden a agosto y septiembre, cuando la cantidad de lluvias no
supera los 200 mm. Por otro lado, la temperatura es relativamente
constante, fluctúa entre los 24 y 26°C (Acosta -
Solis 1977; Cañadas-Cruz 1983).
La parcela descansa sobre dos pequeñas elevaciones con
inclinaciones tenues. En estas pendientes el
suelo es rojizo y arcilloso debido al desprendimiento de la capa
orgánica y de nutrientes que se produce por efectos de las
lluvias. Los valles o quebradas entre las
colinas constituyen la parte más baja de la parcela; éstas
son típicas tierras aluviales grises y cafés, cruzadas
por riachuelos permanentes.
Toma de datos
El presente trabajo se basó en la cuantificación de la
floración de especies arbóreas y lianas, utilizando los
parámetros establecidos por Newstrom et al. (1994),
para la caracterización de la floración. Las
estructuras florales se recolectaron en 200 trampas permanentes
construidas con tubos de PVC que forman un marco cuadrado con cuatro
patas a manera de una mesa. La cara superior constituye una malla
plástica porosa, para permitir que el agua de las lluvias
escurra fácilmente. Las trampas se ubicaron entre cuatro y
diez metros del sendero hacia el bosque; y de esta manera se aseguró
que, las trampas se encuentren suficientemente alejadas tanto del
sendero como de la siguiente trampa.
La recolección de estructuras florales en
las 200 trampas constituyó un censo; el mismo que podía
durar de tres a cinco días dependiendo de las condiciones
climáticas. En total se realizaron 28 censos, uno cada dos
semanas. El material colectado de cada trampa se revisó
y separó por especie, el mismo día, para evitar
alteraciones en las estructuras florales. Luego de secarlo se
clasificó según la colección de referencia del
Proyecto de Plántulas y Semillas para facilitar futuras
comparaciones.
En el análisis comparativo de los
eventos de floración de árboles y lianas, y entre los
diferentes estratos se utilizó el criterio de clasificación
de Foster (Hubbell & Foster 1986), propuesto para estudiar la
dinámica de los bosques en la Red de Parcelas de 50 ha
establecidas por el Centro de Ciencias Forestales del Trópico.
Esta clasificación, actualizada hasta diciembre del 2001,
incluye las siguientes categorías: T.- Árboles del
dosel, mayores a 20 metros; M.- Árboles de
sub dosel, entre los 10 y 20 m; U.- Árboles de sotobosque que
se encuentran entre los 4 y 10 m; S.- Árboles pequeños
y arbustos de sotobosque que llegan hasta los cuatro metros; y V.-
Lianas.
Análisis de los datos
La información obtenida se clasificó en dos categorías:
Registros florales. - que indican la
presencia de flores o botones de una especie en una determinada
trampa; y Registros de cantidad o número de flores. -
que constituye el valor aproximado de la cantidad de flores o botones
de una especie. Este dato se utiliza para describir la intensidad o
amplitud de la floración (Newstrom et al. 1994), y fue tomado
como el valor entero del logaritmo de base 10, en una escala de cero
a tres, por la dificultad de contar flores pequeñas y
numerosas.
Las relaciones entre la floración y las variables ambientales
(precipitación y temperatura) se exploraron a través de
varias correlaciones lineales. Para determinar si existen diferencias
en la floración según la estratificación del
bosque y en diferentes hábitats, se utilizó el Diseño
de Bloques Completos al Azar (DBCA) como modelo estadístico y
Tukey como prueba complementaria (Fowler et al.
1998). La sincronía entre especies relacionadas fue
observada comparando las épocas de floración de cada
especie.
Resultados y Discusión

La evaluación de la floración del
bosque durante 14 meses abarcó 3916 registros florales, de los
cuales el 80,7 % corresponde a flores y el 19,3% a botones, que
representan a 68 familias y 703 especies. Fabaceae, la familia más
abundante en el área de estudio, evidenció también
la mayor cantidad de registros florales, seguida por Arecaceae, la
cual no tiene una diversidad muy alta, pero incluye a Iriartea
deltoidea, la especie más común del área de
estudio. I. deltoidea, no sólo es una especie muy
dominante, también presenta una floración extendida y
fases fenológicas superpuestas, es decir un mismo individuo
puede producir botones, flores y frutos al mismo tiempo.
Estacionalidad de la
Floración
La floración del bosque mostró marcadas diferencias a
lo largo del tiempo de estudio. A mediados de diciembre se observó
mayor diversidad de especies floreciendo, con flores de 114 especies
distintas distribuidas en el 75% de las trampas. Mientras que, a
mediados de mayo sólo 27 especies florecían,
encontradas en menos de la cuarta parte de las trampas ([[Figura
1]]). Por otro lado la amplitud de la floración llegó a
su máximo nivel durante la tercera semana del mes de
septiembre con un número aproximado de 15300 estructuras
florales recolectadas (Figura 2). El Análisis de estos
datos determinó que la estacionalidad de la floración a
nivel de comunidad presenta tres momentos: Floración Activa,
Floración Intermedia y la Temporada de Pocas Flores.
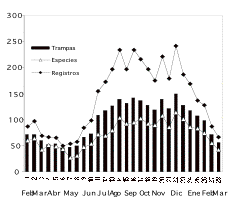
Figura 1. Cantidad
de registros florales, número de especies floreciendo y número
de trampas con al menos una estructura floral reportados en un bosque
de tierra firme de la amazonía ecuatoriana durante 14 meses de
estudio (28 censos), desde febrero del 2000 a marzo del 2001.
Figure 1. Registered flowers, number of species in
flower and number of traps with at least one flower caught, reported
from a terra firme forest in Amazonian Ecuador during 14 months (28
surveys) between February 2000 and march 2001.
Floración activa: comprende a la
acumulación de estadíos florales de diferentes
especies, ya que el bosque florece con mayor intensidad y duración.
Esta temporada inicia en julio y dura hasta mediados de enero.
Incluso aquellas especies que presentaron flores durante todo el año,
en algún momento de estos meses intensifican su floración;
como son los casos de Eschweilera coriacea, Pouroma minor,
Sorocea steinbachii y Virola elongata.
Floración intermedia: se presentan dos
veces al año, antes de la temporada de floración activa
durante en el mes de junio, cuando se nota claramente que la
floración tiende a incrementarse. Entonces florecieron Aniba
riparia, Trichilia adolfii, Inga bourgonii, Inga
auristellae e Eriotheca globosa. Y después de la
temporada de floración activa cuando los niveles de floración
disminuyen, a finales de enero y se extiende durante todo febrero.
Entre las especies que florecieron en este momento están:
Bauhinia spp., Duroia hirsuta, Machaerium
floribundum, Apeiba menbranacea, Dicranostyles
holostyla y Cedrela fissilis.
La Temporada de Pocas Flores: es un tiempo de baja actividad floral,
comprende marzo, abril y mayo. Entre las especies que florecen en
estos meses se encuentran Matisia malacocalix, Sorocea
steinbachii, Pseudolmedia laveis, Guarea gomma,
Trichilia adolfii.
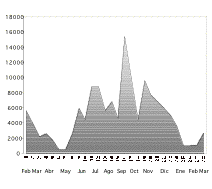
Figura 2. Número aprox. de
estructuras florales (amplitud de la floración) recolectadas
en 200 trampas, distribuidas en un bosque de tierra firme de
la Amazonía Ecuatoriana. Los números del 1 al 28
corresponden los censos o revisiones que se realizaron durante 14
meses, desde febrero del 2000 a marzo del 2001.
Figure 2. Approximate number of flowers collected in 200
traps reported from a terra firme forest in Amazonian Ecuador during
14 months (28 surveys) between February 2000 and March 2001.
La floración y el
clima
Aunque aparentemente la caída de lluvias en el Parque Nacional
Yasuní no presenta una estacionalidad marcada (meses
inferiores a los 100 mm), los análisis realizados indican
variaciones estacionales donde los meses más lluviosos pueden
registrar hasta un 72% más de lluvias que el mes más
seco. Esta variación en la precipitación determina la
estacionalidad en los eventos de floración, de manera que
muchas especies florecen cuando la cantidad de lluvias disminuye
(Figura 3). Por otro lado, la temperatura, como factor
individual, no es determinante en la floración, la correlación
entre esta variable y la producción de flores no
mostró relación alguna, al mantener valores
relativamente constantes durante todo el año ([[Tabla 1]]).
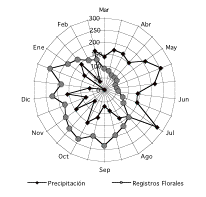
Figura 3. Relación
entre la precipitación y la cantidad de registros florales
durante 14 meses de un bosque de tierra firme en la Amazonía
Ecuatoriana, (desde el 2000 al 2001). Se uso promedios para los meses
que se repiten durante el tiempo de estudio (febrero y marzo). Los
valores numéricos expresan la cantidad de mm de lluvia y la
frecuencia de registros florales.
Figure 3. Relation between rainfall and flowers reported
from a terra firme forest in Amazonian Ecuador during 14 months (28
surveys) between February 2000 and March 2001. Median used for the
repeated months (February and march). Numerical values indicate
rainfall in mm and lower number.
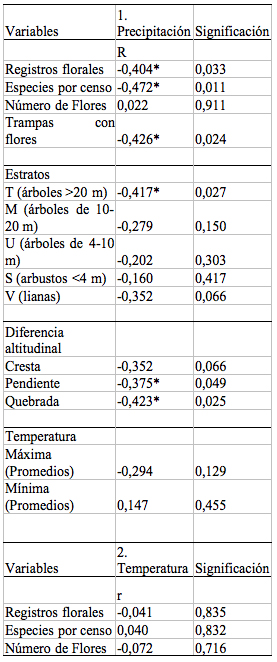
Tabla 1. Resultados
de la Correlación de Pearson (r) entre la floración de
un bosque de tierra firme en la Amazonía Ecuatoriana y las
variables ambientales registradas (precipitación y
temperatura). Las correlaciones se realizaron para las diferentes
variables en que se midió la floración, así como
también para cada estrato y nivel altitudinal.
Table 1. Pearson correlation (r) between flowering and
registered environmental parameters (precipitation and temperature)
reported from a terra firme forest in Amazonian Ecuador during 14
months (28 surveys) between February 2000 and march 2001. The
correlations are made for different variables in flowering for every
stratum and altitudinal level.
Arboles y lianas,
estrategias distintas?
Tanto árboles como lianas produjeron mayor cantidad de flores,
dentro de "la temporada de floración activa" (r
= 0.548; p = 0.003), pero la floración no fue
simultánea (Figura 4), las lianas florecieron cuando la
mayoría de los árboles ya habían florecido o
estaban por florecer (rs= -0.545; p =
0.044). Esto probablemente se debe a que las flores de estas
dos formas de vida ocupan los mismos niveles en la estructura
vertical del bosque, de tal forma que un comportamiento alternado en
los tiempos de floración, evita la competencia por los
polinizadores y posteriormente por los dispersores, cuando los frutos
estén maduros.
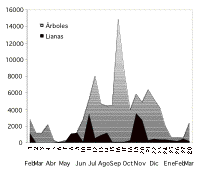
Figura
4. Cantidad de estructuras florales de árboles y lianas de un
bosque de tierra firme de la Amazonía Ecuatoriana, encontrados
en 28 censos o revisiones durante 14 meses, desde febrero del 2000 a
marzo del 2001.
Figure 4.
Number of flowers on trees and lianas reported from a terra firme
forest in Amazonian Ecuador during 14 months (28 surveys) between
February 2000 and march 2001.
La Floración en los diferentes
estrato
Los árboles grandes del dosel (T) y
subdosel (M), producen más flores, y las diseminan a mayores
distancias; por lo tanto, dominan el ciclo de floración del
bosque. Además estas dos categorías son precisamente
las que presentan mayor estacionalidad, ya que las condiciones, de
luz y humedad, a las que pueden alcanzar los árboles altos a
través del dosel son muy diferentes a las que se encuentran
dentro del bosque Frankie (1974). En consecuencia, las especies
responsables de los picos en las curvas de floración son
Alchornea triplinervia, Virola duckei, Cedrelinga
cateniformis, Otoba glycycarpa y Parkia multijuga.
La floración en
diferentes hábitats
La floración en las crestas de las colinas es diferente a la
que se presenta en las pendientes y en las quebradas (F = 42.018; p =
0.000; CV= 4.82%). Lo que se debe a dos razones: primero; en la parte
alta de las colinas, la densidad de árboles y la riqueza de
especies es mayor a la de las partes bajas, razón por lo cual,
el número de registros florales y de especies floreciendo es
mayor. Y segundo; las especies florecen en respuesta a la disminución
de la humedad de suelo. Cuando la cantidad de lluvias disminuye, los
suelos de diferentes hábitats se secan proporcionalmente a la
altura (Foster 1990). Es decir, la humedad del suelo en la cresta se
escurre más rápido que en los otros dos niveles, lo que
se evidencia en el valor de las correlaciones ([[Tabla 1]]).
Sincronía en la
Floración
A nivel de comunidad existe una floración sincrónica
intra e interespecífica entre la mayoría de árboles,
arbustos y lianas del bosque, los cuales florecen cuando la cantidad
de lluvias disminuyen. Sin embargo al analizar con detalle los
eventos de floración de cada especie se observó que las
especies cercanas, del mismo género o familia, tienden a
mantener sincronía en sus épocas de floración.
Entre las ventajas de la floración sincrónica están
la posibilidad de atraer a una mayor cantidad de polinizadores,
aumentar el potencial de entrecruzamiento a nivel intraespecífico
(Augspurger 1990) y conducir a un desarrollo sincrónico de que
sacian a los predadores, que de otro modo destruirían la
producción de semillas y la productividad del bosque (Garwood
1983). La asincronía en cambio, predispone a las plantas a
recompensar ricamente a los polinizadores ya que impulsan a una clase
de especialistas a regresar una y otra vez en busca de su alimento
(Leigh 1990). Entre algunos ejemplos de sincronía están
las especies de los Parkias, Ingas, Bauhinias,
Guareas, etc. Estas involucran fases activas de floración
dentro del espacio de tiempo correspondiente a la realización
de los censos. Sin embargo, los tiempos de floración difieren
en horas, días e incluso semanas. Estas diferencias concuerdan
con la hipótesis del "polinizador compartido"
(Wright & Calderón 1995) según la cual los tiempos
de floración deben estar segregados para evitar la sobre
posición de congéneres que tienen estructuras florales
similares y por lo tanto, los mismos polinizadores.
Agradecimientos

El presente trabajo fue posible gracias al Proyecto de Plántulas
y Semillas (SSP) que auspició, financió y motivó
esta investigación. A la Dra. Nancy Garwood, el Dr. Joseph
Wright y Viveca Persson. Mi reconocimiento también al Dr.
Renato Valencia, Gorki Villa y especialmente al
Dr. Hugo Navarrete por la dirección de este trabajo. Por
último, mis más sinceros agradecimientos al Sr. Milton
Zambrano, la Estación Científica Yasuní y el
Herbario QCA de la Pontificia Universidad Católica del
Ecuador.
Referencias

Acosta - Solis, M. 1977. Conferencias Fitogeográficas.
Instituto Panamericano de Historia y Geografía. Quito,
Ecuador.
Augspurger, K.C. 1990. Una Señal para la floración
sincrónica. Pp. 201-218. En: E.G.
Leigh, Rand, A.S. & D. Windsor, (eds.) Ecología
de un Bosque Tropical. Smithsonian Tropical Research Institute,
Panamá.
Cañadas - Cruz, L. 1983. El Mapa Bioclimático y
Ecológico del Ecuador, MAG - PRONAREG. Quito, Ecuador.
Foster, R.B. 1990. Ciclo estacional de caída
de Frutos en la Isla de Barro Colorado. Pp.
219-241. En: E.G. Leigh, A.S. Rand & D. Windsor (eds).
Ecología de un Bosque Tropical.
Smithsonian Tropical Research Institute, Panamá.
Fowler, J; L. Cohen & P. Jarvis. 1998.
Practical Statistics for Field Biology. Copy Right - Wiley.
England.
Frankie, G.W. 1974. Tropical plant phenology:
Aplication for estudies en community ecology. Pp. 287-296. In:
H. Lieth (ed.). Ecological Studies. Vol 18. Phenology and
Seasonality modeling. Springer - Verlag. New York, U. S.A.
Garwood, N.C. 1983. Seed Germination in a Seasonal
Tropical - Forest in Panama. A Conmunity Study. Ecological
Monographs, 53(2):159-181.
Hubbell, S. & R. Foster. 1986. Communness and
Rarety in a Neotropical Forest: Implication for Tropical Tree
Conservation. Pp 205-231. In: M. Soulé (ed.).
Conservation Biology. Sinauer Associates, Inc., Massachusetts,
U.S.A.
Leigh, E.G. 1990. Introducción: La
Selección Natural y los Ciclos del Bosque. Pp.
175-178. En: Leigh, E.G.; A.S. Rand & D. Windsor (eds.).
Ecología de un Bosque Tropical.
Smithsonian Tropical Research Institute, Panamá.
Newstrom, E.; G. Frankie; G. Baker & R.
Colwell. 1994. Diversity of Long - term Flowering Patterns. Pp.
142-160. In: McDade, L.; K. Bawa; H.
Hespenheide & G. Hartshorn (eds). La
Selva, Ecology and Natural History of a Neotropical Rain Forest.
University of Chicago Prees, Ltd. U.S.A.
Raven, P; R.F. Everte & S. Eichhorn. 1999.
Biology of plants. W.H. Freeman and Company
worth publishers. New York, U.S.A.
Romoleroux, K; R. Valencia; R. Condit; H. Balslev
& E. Losos. 1997. Inventario de 2 hectáreas en Yasuní.
Pp 189-216. En: Valencia, R. & H.
Balslev (eds.). Estudios sobre la diversidad y Ecología de
plantas. PUCE. Quito, Ecuador
Sierra, R. (ed.), 1999, Propuesta Preliminar de un Sistema de
Clasificación de Vegetación para el Ecuador
Continental. Proyecto INEFAN/GEF-BIRF y EcoCiencia. Quito, Ecuador.
Wright, S.J. & O. Calderón.1995.
Phylogenetic constraints on tropical
flowering phenologies. Journal of Ecology 83: 937-948.
Wright, S.J. 1996. Phenological Responses to
Seasonality in tropical Forest Plants. Pp 440-461. In: Mulkey,
S.S.; R.L. Chazdon & A.P. Smith (eds.).Tropical Forest Plant
Ecophysiology. Chapman y Hall. New York, U.S.A.
Anexo 1.- Lista de
nombres científicos mencionados como ejemplos el un estudio de
la Floración a nivel de Comunidad de un Bosque de tierra Firme
en la Amazonía Ecuatoriana.
Annex 1. Scientific names mentioned as examples in this
study from a terra firme forest in Amazonian Ecuador.





